Искусственные
органы как путь к радикальному продлению жизни
главы из брошюры,
черновик (версия 23 05 11 )
Предисловие
Разработка
приборов, способных брать на себя функции органов человеческого тела - одно из
передовых направлений современной медицины. У организма есть множество функций:
моторная, сенсорная, интеллектуальная и другие. Первые попытки восполнения
функций частей тела имели место несколько веков назад, но подлинно интенсивное
развитие данной области началось лишь в XX веке.
На
сегодняшний день, относительно высокого уровня достигло протезирование рук и
ног. Достаточно вспомнить такие достижения 2000 годов, как высокореалистичный протез
руки от компании Touch Bionics, ножные протезы от компании Ossur, из-за
"нечестных" беговых преимуществ которых спортсмен Оскар Писториус был
отстранён от участия в Олимпийских играх, а также простые, но практичные и
предельно дешёвые ножные протезы от компании Motion Designs. Разрабатываются
всевозможные типы экзоскелетов, ведётся работа над соединением мозга и
электронных систем управления механическими устройствами. Всё это даёт
серьёзные основания считать, что уже нынешнее поколение 30-40 летних людей в
пожилом возрасте будет избавлено от проблем с поддержанием активного образа
жизни.
Но особое
место среди функций человеческого организма занимает функция собственного
жизнеобеспечения. Если она не выполнена, то нет смысла говорить и о реализации других
функций. Критически важные для жизни органы - это лёгкие, сердце, почки,
сосудистая и пищеварительная системы, печень, а также некоторые другие
компоненты. Уже сегодня существует оборудование, способное восполнять функции
большинства основных органов жизнеобеспечения в течение продолжительного
времени. Например, максимальный срок жизни человека со вспомогательным
искусственным сердцем составляет 9 лет, максимальный срок жизни с
использованием искусственных почек – 40 лет, максимальное время жизни пациента,
питающегося от капельницы (минуя желудочно-кишечный тракт) – более 30 лет.
Результаты, касающиеся других органов, пока более скромны, но и по ним есть
прогресс.
В данной
работе мы покажем, что в ближайшие годы в области разработки искусственных органов
можно ожидать принципиального переворота: благодаря росту своих технических
возможностей, из крайнего средства спасения жизни они обещают превратиться в
средство её терапевтического продления. В широкую практику может войти
превентивное использование искусственных органов, а для людей преклонного
возраста – замена больших блоков изношенного тела технологическими
компонентами, допускающими простую замену и ремонт при поломке. Мы покажем, в
частности, что уже в ближайшие 5 лет на основе существующих серийных устройств
при должной организации работ может быть разработана интегрированная система,
способная в течение долгого времени поддерживать жизнедеятельность
изолированной головы животного. В дальнейшем, технология может быть применена
для радикального продления жизни стариков преклонного возраста с полиорганной
недостаточностью. В более отдалённом будущем можно ожидать построения
полноценного кибернетического тела с биологическим мозгом и роботизированными
всеми прочими компонентами - органами жизнеобеспечения, моторными и сенсорными
частями.
Все условия к
началу таких разработок существуют, и рано или поздно приведённые
“фантастические” результаты будут получены. В данной работе мы обсуждаем
возможные подходы к радикальному продлению человеческой жизни с помощью
искусственных органов и предлагаем оптимальные стратегии в этом направлении для
больших и малых групп разработчиков
Оглавление
Глава 1.
Искусственные органы как средство увеличения надёжности человеческого тела
1.1
Критические подсистемы организма
1.2
Основные подходы к увеличению надёжности организма
1.3
Перспективы сокращения набора незаменимых компонент человеческого тела с
помощью медицинских технологий
Глава
2. Современные достижения в области искусственного жизнеобеспечения
человеческого тела
2.1 Общая
концепция системы искусственного жизнеобеспечения
2.2 История и
современные возможности искусственного восполнения механических и химических функций
жизнеобеспечения
2.21
Искусственное сердце
2.22
Искусственные лёгкие
2.23
Искусственная почка
2.24
Искусственная печень
2.25
Искусственное (парентеральное) питание
Глава 1. Искусственные органы как средство
увеличения надёжности человеческого тела
1.1
Критические подсистемы организма
Основной
задачей медицины является продление сознательной и комфортной жизни пациентов.
Говоря иначе - увеличение надёжности компонент человеческого организма,
которые нужны для поддержания “минимально полноценной” жизни.
В организме
всех высших животных включая человека можно выделить две критические
подсистемы.
- Критическая
подсистема 1: жизнеобеспечивающие
компоненты (ЖОК). К
этой подсистеме мы будем относить все органы, ткани и их технические
аналоги, которые необходимы для поддержания жизнедеятельности
биологического тела. Сюда
относится кровь, пищеварительная, сердечно-сосудистая и
выделительная системы. В условиях дикой природы, к ЖОК также можно отнести
сенсоры и конечности, утрата которых лишает животное способности к
выживанию. Некоторые ЖОК в случае потери могут быть восстановлены,
например, конечности у земноводных или небольшой объём крови у высших
позвоночных
- Критическая
подсистема 2: незаменимые
компоненты (НЗК). К
этой подсистеме мы будем относить биологические органы и ткани, которые
необходимы для сознательной и минимально комфортной жизни, и в случае
утраты не могут быть восполнены (в данных конкретных условиях). К
незаменимым компонентам современного человека и высших животных относятся нервные
структуры, необходимые для поддержания организма в сознании, минимальный
набор сенсоров, а также ЖОК, неспособные к регенерации.
Наличие в
теле большого набора незменимых
компонент – фундаментальный источник ненадёжности организма. Существование
больших и сложных систем без замены и ремонта ограничено чисто
термодинамическими законами. Для различных частей тела характерные времена
эффективной работы в идеальных условиях различны. Например, нейроны при должном
обслуживании могли бы существовать несколько сотен лет, тогда как большинство
других незаменимых компонент с трудом может перешагнуть столетний рубеж.
Особенно важно, что ряд компонент одновременно являются и незаменимыми, и
жизнеобеспечивающими (рис. 1-1). Они
критически важны “вдвойне”: они не только необходимы для поддержания жизни, но
и сами нуждаются в обслуживании.
1.2
Основные подходы к увеличению надёжности организма
Значительное
увеличение продолжительности жизни организма с помощью технологий может
осуществляться в рамках следующих трёх подходов
Подход 1. Сокращение набора незаменимых компонент
тела: разработка технологий замены утраченных тканей естественными или
искусственными аналогами (регенерация, трансплантация и киборгизация) .
- Преимущества
подхода. Значительный
прогресс может быть достигнут без получения новых важных фундаментальных
знаний. Имеют место, в основном, не научные, а технические проблемы, и они
имеют конкретные перспективы решения
- Недостатки
подхода. Предел сокращения
набора НЗК неизвестен. Конкретно, неизвестны пределы заменяемости нервной
ткани, при которых сохраняется исходная личность человека. Очевидно, что
большая часть нервной ткани теоретически допускает такую замену. Нельзя,
однако, исключить, что определённая небольшая часть нейронов
непосредственно ответственна за субъект сознания (Sevush 2006), и их заменять нельзя (см. Главу
3)
Подход 2. Неразрушающий ремонт незаменимых
компонент тела. Из современных технологий сюда можно отнести “традиционные”
терапевтические процедуры, восстанавливающие функции компонент без регенерации
и замены, в будущем же значительный прорыв в этой области может быть обеспечен
использованием микро- и нанороботов для ремонта повреждений на клеточном
уровне.
- Преимущества
подхода. Почти
неограниченные возможности в будущем. При наличии высокоразвитых
нанотехнологий теоретически возможно даже поддержание неизменного атомного
состава клеток в течение неограниченного времени.
- Недостатки
подхода. Ограниченные
возможности современных методов и высокие технические сложности на пути
разработки радикальных методов. Ремонтирующие нанороботы пока что остаются
лишь теорией и неизвестно, когда появятся действенные конкретные прототипы
Подход 3. Профилактическое повышение надёжности
незаменимых компонент тела. Главным образом, сюда относятся борьба против
старения на клеточном уровне (например, через активацию теломеразы (Harley,
Liu, Blasco, et al 2011)) и геннная
инженерия
- Преимущества
подхода. Профилактические
средства могут иметь форму обычных медикаментов или малоинвазивных
процедур, а потому быстро получить широкое распространение
- Недостатки
подхода. Неясность
перспектив, обилие нерешённых фундаментальных вопросов. Механизмы старения
остаются во многом непонятными, и это препятствует получению результатов.
Кроме того, возможности подхода фундаментально ограничены
термодинамическими соображениями (старение может быть лишь замедлено, но
не устранено полностью)
Сегодня мы не
знаем, в рамках какого из подходов будут получены первые значительные
результаты в увеличении продолжительности жизни. Настоящая работа посвящена
анализу первого подхода, который выгодно отличается от двух других тем, что
может интенсивно развиваться уже сейчас. В рамках первого подхода не
требуется ни сложных нанотехнологий, ни построения “окончательной” теории
старения. А поскольку из всех НЗК в технологиях замены и ремонта в первую
очередь нуждаются незаменяемые жизнеобеспечивающие компоненты (они менее
надёжны, чем информационные системы), то проблема пределов заменяемости нервных
структур тоже не является препятствием
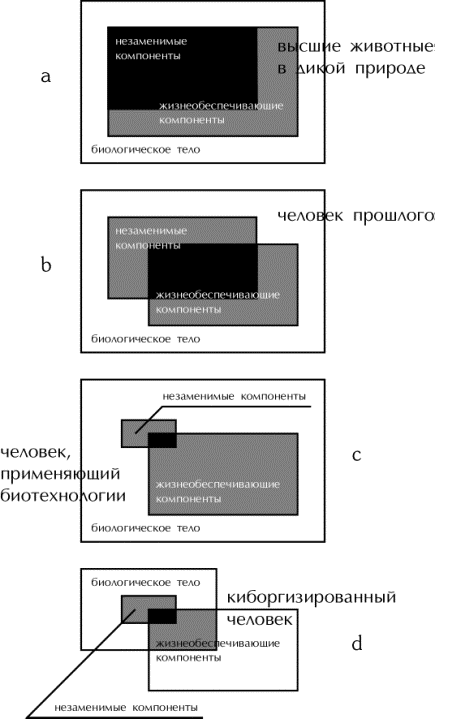 1.3 Перспективы сокращения набора незаменимых
компонент человеческого тела с помощью медицинских технологий
1.3 Перспективы сокращения набора незаменимых
компонент человеческого тела с помощью медицинских технологий
Рассмотрим, как
менялись границы двух критических подсистем организма при переходе человека от
первобытного состояния к цивилизации, и как они будут меняться в будущем при
условии применения тех или иных медицинских технологий (рис. 1-1). На приведённой схеме критические
подсистемы отмечены серым цветом, а их пересечения (особенно проблемные с точки
зрения надёжности) – чёрным цветом. Чем меньше на схеме тёмных цветов, тем она
надёжнее
В
агрессивной естественной среде обитания большинства животных практически всё тело является необходимым
для выживания (то есть относится к ЖОК). Незначительное повреждение или
старение приводит к тому, что особь становится беззащитной перед хищниками или
неспособной эффективно добывать пищу. Незаменимые компоненты тела – это ЖОК, неспособные
к регенерации. Низшие многоклеточные животные демонстрируют широкие способности
к регенерации, поэтому значительная часть их организма является заменяемой. У
высших же животных в естественных условиях большинство сложных органов являются
незаменяемыми (рис. 1-1 a).
В
человеческом социуме прошлого появилась
забота об инвалидах, что сделало многие части тела (например, конечности),
необязательными для выживания. Потеря их сказывается, в основном, на качестве
жизни. В дальнейшем, человеческое общество даже научилось поддерживать жизнь
людей в бессознательном (вегетативном) состоянии. Таким образом, у человека
критические подсистемы хотя и пересекаются, но не совпадают (рис. 1-1 b). Число ЖОК уменьшилось, число НЗК
практически не изменилось
Применение
биотехнологий создало тенденцию
к сокращению набора НЗК. Современная медицина достигла успехов в вопросах
замены некоторых ЖОК, которые раньше не допускали замены. Так, переливание
крови дало возможность восполнять практически весь её объём, тогда как в
естественном состоянии кровь способна к регенерации лишь в случае потери
небольшой её части. Развитие трансплантологии дало возможность заменять и такие
жизненно важные органы, естественное восстановление которых вовсе нереально.
Современные возможности
Рис. 1-1. Соотношение между незаменимой и
жизнеобеспечивающей подсистемами организма животных и человека на разных
стадиях развития технологий
трансплантологии
ограничены дефицитом органов для пересадки и сложностью хирургических процедур,
но в недавние годы интенсифицировались исследования, призванные решить эти
проблемы. Ведутся исследования по выращиванию новых органов и частей тела
непосредственно для трансплантации (Metallo,
Azarin, Ji et al 2008), изучаются возможности искусственного стимулирования регенерации (Mason & Dunnill 2008),
рассматриваются вопросы искусственной сборки органов из отдельных тканей и
клеток, в том числе – автоматизированным трёхмерным клеточным принтером (Mironov, Boland, Trusk, Forgacs, & Markwald 2003).
Вероятно, в будущем можно будет всерьёз поставить вопрос и о выращивании или
сборке целых запасных тел для трансплантации головы или мозга пациента. На
сегодняшний день, такая трансплантация невозможна из-за проблематичности
соединения нервной ткани, хотя и опыты в этом направлении проводятся ещё с
1950-х годов (Демихов 1960, White, Albin, Locke, & Davidson 1965).
Пересадка мозга в новое тело имеет огромное преимущество перед другими видами
трансплантации, состоящее в отсутствии отторжения трансплантанта. В любом случае,
развитие трансплантологии обещает в будущем существенно увеличить надёжность
человеческого организма благодаря сокращению в нём набора НЗК (рис. 1-1 c)
Искусственные
органы и киборгизация
являются альтернативной стратегией увеличения надёжности живого организма. Если
биотехнологии делают ставку на сокращение числа НЗК при сохранении примерно
неизменной общей биомассы, то киборгизация обещает вынести значительную часть
ЖОК из организма, сократив общий объём биологических компонент (рис. 1-1 d). Впервые возможность такого подхода была в
эксперименте продемонстрирована ещё в 1926 году. С. Брюхоненко и С. Чечулиным,
которые представили публике отделённую голову собаки, жизнедеятельность которой
в течение нескольких часов поддерживалась искусственным сердцем и донорскими
лёгкими (Брюхоненко & Чечулин 1926). Похожий эксперимент, но уже с
использованием искусственного оксигенатора вместо лёгких, был осуществлён в
1963 году Р. Вайтом, который 3 дня поддерживал жизнь мозга, взятого у обезьяны
(White, Albin, & Verdura 1963). Киборгизация имеет следующие преимущества
перед чисто биологическими решениями
- Небиологические ЖОК допускают ремонт и
модернизацию без проведения хирургических операций .
- Небиологические ЖОК не подвержены
биологическому старению, закономерности которого до сих пор не вполне
изучены
- Нагрузка на ЖОК может быть существенно
снижена благодаря уменьшению обслуживаемой ею биомассы. Это снижает
требования к габаритам и техническим характеристикам устройств, расширяя
возможности по увеличению их запаса прочности
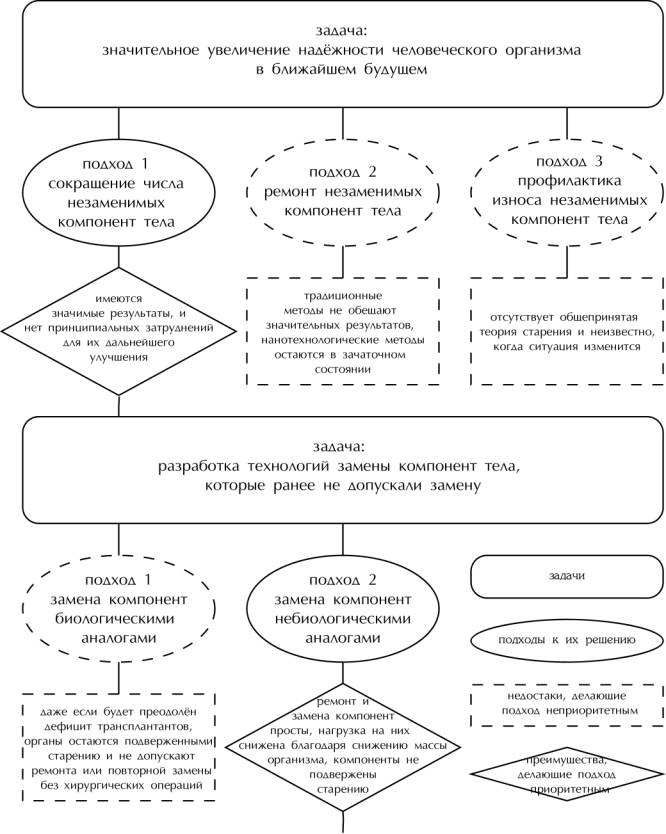
Рис. 1-2. Киборгизация
жизнеобеспечивающих компонент тела как приоритетный метод радикального
увеличения надёжности человеческого организма и в ближайшем будущем
Резюмируя приведённые аргументы (рис.
1-2), можно сделать вывод, что именно киборгизация жизнеобеспечивающих
компонент в обозримой перспективе способна обеспечить наиболее значительное
увеличение продолжительности жизни человека. И потому, именно этому
направлению посвящена настоящая работа
Список литературы к Главе 1
- Брюхоненко С
С, Чечулин С И (1926), Опыты по изолированию головы собаки (с
демонстрацией прибора) // Труды II Всесоюзного съезда физиологов. — Л.:
Главнаука, — С. 289-290
- Демихов
В П (1960), Пересадка жизненно важных органов в
эксперименте. — М.: Медгиз
- Harley C B, Liu W, Blasco M, Vera E, Andrews W
H,.Briggs L A, Raffaele J M (2011), A Natural Product Telomerase Activator
As Part of a Health Maintenance Program // Rejuvenation Research. 14 (1),
45-56.
- Mason C, Dunnill
P (2008), A brief definition of regenerative medicine // Regenerative
Medicine 3 (1), 1–5.
- Metallo C M,
Azarin S M, Ji L, de Pablo J J, Palecek S P (2008), Engineering tissue
from human embryonic stem cells // J Cellular and Molecular Medicine 12
(3), 709–729.
- Mironov V, Boland T,
Trusk T, Forgacs G, Markwald R R (2003), Organ printing:
computer-aided jet-based 3D tissue engineering // Trends in Biotechnology
21 (4), 157-161
- Sevush S (2006), Single-neuron theory of
consciousness // J Theor Biol 238 (3), 704-725
·
White R J, Albin M
S, Verdura J (1963), Isolation of the monkey brain: in vitro preparation and
maintenance // Science 141, 1060
·
White R J, Albin
M S, Locke G E, Davidson E (1965), Brain transplantation: prolonged survival of
brain after carotid-jugular interposition // Science 150, 779.
- White R J, Albin M S, Locke G E, Davidson E
(1965), Transplantation of the isolated canine brain // Physiologist 8,
304
Глава 2. Современные достижения в области искусственного
жизнеобеспечения человеческого тела
2.1 Общая
концепция системы искусственного жизнеобеспечения
Базовая схема
системы жизнеобеспечения биологической ткани приведена на рис. 2-1.

Рис.
2-1. Базовый вид системы жизнеобеспечения биологических тканей
Главными функциями
жизнеобеспечивающих компонент (ЖОК) являются
- Доставка к тканям питания и окислителя (O2)
- Очистка тканей от продуктов
жизнедеятельности и токсинов
- Защита тканей от вредоносных
микроорганизмов
Кратко перечислим
основные компоненты, ответственные за эти функции в биологическом организме и
укажем современные возможности их искусственного восполнения
Группа 1. Рабочее
вещество. К этой группе
относятся компоненты, непосредственно контактирующие с обслуживаемыми клетками.
В биологическом организме рабочим веществом является кровь. Она содержит несколько
составляющих с разными функциями: эритроциты транспортируют газообразные
вещества, плазма – жидкие, лейкоциты уничтожают микроорганизмы и
т. д. По сей день максимальное время использования искусственных
кровезаменителей составляет лишь порядка суток. Поскольку кровь является
заменяемым компонентом тела, её техническое восполнение можно считать
неприоритетным
Группа 2. Компоненты,
поддерживающие циркуляцию рабочего вещества. Сюда относятся компоненты, обеспечивающие
перемещение рабочего вещества между тканями и ЖОК групп 3 и 4. В биологическом
организме эта функция реализуется сердцем и сосудами. Искусственные сердца
представляет собой насосы различной конструкции. Современные
полнофункциональные искусственные кровяные насосы способны обеспечивать
жизнедеятельность до 2 лет, вспомогательные (менее мощные) –
более 7 лет по состоянию на 2008 год (Westaby, Siegenthaler, Beyersdorf et al 2010)
Группа 3. Компоненты,
поддерживающие химический состав рабочего вещества. К этой группе относится большинство ЖОК тела
высших животных. Выделим основные из них.
- Лёгкие снабжают кровь кислородом и выводят
углекислый газ. Искусственный аналог лёгкого называется оксигенатором.
Современные устройства способны обеспечивать жизнедеятельность до 117
дней (Wang, Chou, Ko, Lee 2010).
- Пищеварительная
система снабжает кровь
питательными веществами. Искусственные аналоги пищеварительных органов
пока далеки от практического применения, однако кровь можно снабжать
готовыми промышленно полученными веществами. Парентеральное (минующее
желудочно-кишечный тракт) питание с помощью капельниц и имплантируемых
портов длительного использования - хорошо отработанная процедура,
способная поддерживать жизнедеятельность пациентов более 32 лет
(по состоянию на 2004 год, ссылка будет добавлена в полной редакции).
- Эндокринная
система снабжает кровь
гормональными веществами. Искусственные аналоги соответствующих органов
пока далеки от практического применения, однако кровь можно снабжать
готовыми промышленно полученными веществами. Гормональные препараты
допускают как непосредственный инъекционный ввод в кровоток (инсулин), так
и, например, трансдермальную
абсорбцию (половые гормоны). Выполнение данных процедур хорошо отработано
и позволяет восполнять функции в течение многих десятков лет. В частности,
максимальное зарегистрированное время жизни пациента, инъекционно
поддерживающего уровень инсулина, в 2003 году составило более 81
года (Mazur 2003).
- Печень имеет множество функций, среди которых
основной является удаление токсинов. В частности, печень удаляет из крови
аммиак (синтезируя из него мочевину), и белковосвязываемые токсины -
билирубин, фенол и др. (включая их в состав желчи). Искусственные аналоги
печени по сей день довольно несовершенны и допускают полнофункциональное использование не более 4 дней
(Arora, Thekkekandam, Tesche 2010).
- Почки удаляют из организма мочевину,
произведённую печенью. Современные искусственные аналоги почки способны
поддерживать жизнедеятельность более 41 года (ссылка будет добавлена
в полной редакции).
Группа 4.
Компоненты, поддерживающие биологический состав рабочего вещества. Помимо химических компонент, кровь содержит
биологические компоненты, продолжительность жизни которых невелика. Это
эритроциты, лейкоциты и т. д. Существуют попытки создания кровезаменителей, где
все необходимые функции выполняются химическими компонентами. Например, перфторуглероды
способны выполнять функцию эритроцитов (Riess, Le Blanc 1978). Однако сегодня полный
переход к использованию небиологического рабочего вещества технически
нереалистичен, поэтому необходимость в восполнении биологических компонент
остаётся. В организме млекопитающих компоненты крови производятся костным мозгом. Чисто искусственных аналогов
костного мозга не существует. Существуют разработки гибридных устройств,
содержащих искусственно выращенные кроветворные клетки (Nichols, Cortiella, Lee
et al 2009), однако пока более надёжным методом
обновления биологического состава крови остаётся переливание крови от доноров.
Существуют также разработки промышленных методов получения крови из стволовых
клеток (Lu, Feng, Park, et al 2008). Таким образом, не смотря на отсутствие
искусственных кроветворных органов, искусственное восполнение кровяного состава
не является принципиальной проблемой, а в будущем, вероятно,
здесь исчезнут также технические и экономические затруднения
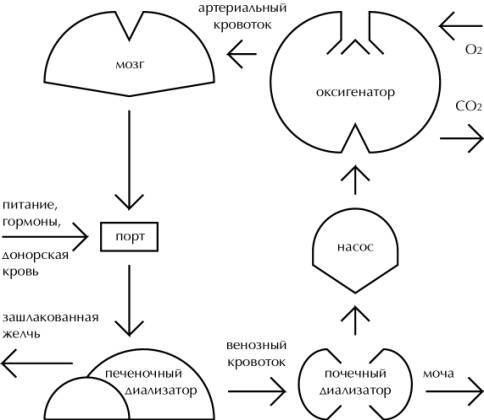
Рис.
2-2. Развёрнутая система жизнеобеспечения биологического мозга с использованием
биологической крови
На рис. 2-2 и 2-3 приведены примеры
возможных схем построения системы жизнеобеспечения биологической ткани
(например, мозга) на основе естественной крови. Здесь используется один круг
кровообращения, и отсутствуют компоненты (пищеварительные, эндокринные,
кроветворные), результат работы которых легко может быть восполнен
непосредственным вводом веществ в кровь. На рис. 2-2 приведена развёрнутая
система, самостоятельно выполняющая большинство жизнеобеспечивающих функций. На
рис. 2-3 приведена альтернативная минимальная схема, в которой сохранены лишь
те компоненты, которые требуют бесперебойной работы (перекачивание крови и
газообмен), а остальные функции реализуются путём регулярного вливания чистой
крови. Обе схемы на сегодняшний день близки к тому, чтобы быть технически
реализованными. Схема 2-2 технически довольно сложна, схема 2-3 предельно
проста, но требует ежесуточного вливания чистой крови либо наличия большого
избыточного количества крови в системе. Даже по скромным оценкам современных
технических характеристик искусственного сердца и лёгких, эта схема может
работать в эксперименте на протяжении месяцев, однако её массовое клиническое
применение для жизнеобеспечения пациентов (или киборгов) пока невозможно из-за
отсутствия столь обширных источников чистой крови (в будущем, вероятно, эта
проблема будет решена). Поскольку кровь является в значительной степени
заменяемым ЖОК, мы оставим пока в стороне вопросы создания кровезаменителей и
искусственных кроветворных органов, и сосредоточим внимание на проблемах
киборгизации и искусственного восполнения функций ЖОК групп 2-3
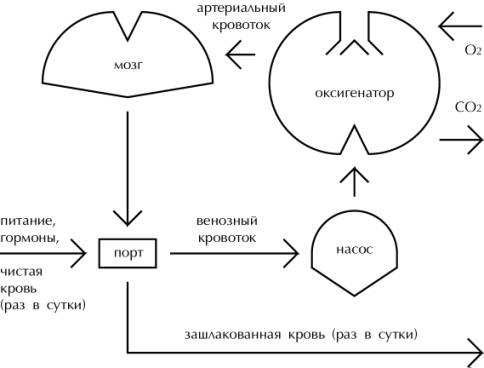
Рис. 2-3. Минимальная система жизнеобеспечения
биологического мозга с использованием биологической крови
2.2 История и
современные возможности искусственного восполнения механических и химических функций
жизнеобеспечения
Аббиривеатуры,
используемые для классификации искусственных органов
По принципу работы
- А – аппаратный (функция реализуется чисто
искусственными средствами)
- Г – гибридный (функция полностью или частично
реализуется с биологическими клетками, включёнными в состав устройства)
По степени портативности
- И – интегрированный / имплантируемый (устройство допускает функционирование
внутри тела)
- Н – носимый (основная часть устройства находиться
вне тела, но пациент сохраняет значительную мобильность и может легко
переносить устройство с места на место)
- С – стационарный (устройство не допускает мобильности
пациента, как минимум – во время процедур)
По степени функциональности
- П – полнофункциональный (способный в естественном окружении
заменить орган целиком)
- В – вспомогательный (способный поддерживать
жизнедеятельность только в связке с другим устройством или ослабленным
естественным органом, либо в условиях существенного сниженнной нагрузки на
ЖОК при радикальной киборгизации)
Примеры
- АСП сердце – аппаратное (полностью искусственное)
стационарное полнофункциональное сердце
- ГНП почка – гибридная (содержащая биологические
клетки) носимая полнофункциональная почка
2.21
Искусственное сердце
Основные типы устройств
- АСП насосы
(аппараты
искусственного кровообращения, cardiopulmonary bypass, heart-lung machine). Используются как временная мера при
операциях
- АНВ и АИВ насосы (ventricular assist device, heart assist
device). Долгосрочно
используются в связке с биологическим сердцем
- АИП сердца (total
artificial heart). Среднесрочно
восполняют всю сердечную функцию, как правило, используются при ожидании
пациентом трансплантата
История
разработок
1925 С. Брюхоненко и С. Чечулин (СССР)
конструируют первый АСП насос, способный заменить сердце, и применяют его для
поддержания жизни отделённой головы
собаки в связке с донорскими лёгкими. В
экспериментах головы собак сохраняли жизнеспособность в течение нескольких
часов, оставаясь в сознании и даже употребляя пищу (Брюхоненко, Чечулин 1926,
Лапчинский 1964).
1937. В. Демихов (СССР) кустарно изготавливает
первый экспериментальный образец АИП сердца и испытывает его на собаке в
течение полутора часов, после чего собака погибает (Лапчинский 1964).
1953. Дж. Гиббон (США) при операции на человеческом
сердце впервые успешно применяет АСП сердце и лёгкие. Начиная с этого времени,
стационарные аппараты искусственного кровообращения становятся неотъемлемой
частью кардиохирургии (Gibbon
1970).
1959. Д.
Лиотта (США) в экспериментах на собаках доводит время непрерывного
использования АИП сердца до 12 часов (Liotta, Taliani,
Giffoniello 1961).
1963. В
экспериментах на собаках время непрерывного использования АИП сердца доведено
до 36 часов (ссылка будет
добавлена).
1966.
А. Кантровиц (США) поддерживает жизнь пациента с помощью АНВ насоса М ДеБэйки в
течение 10 дней. В результате пациент восстанавливается (DeBakey 1971).
1968.
В. Бернхард (США) в эксперименте на телёнке ставит рекорд непрерывного
использования АНВ сердца 120 дней. На тот момент, это на два порядка
превосходит возможности полнофункциональных устройств (Bernhard, LaFarge, Robinson, et al 1968).
1969. Д. Лиотта и Д. Кули (США) впервые применяют
АИП сердце в клинической практике. Оно поддерживает жизнь пациента в течение 64
часов в ожидании человеческого трансплантанта. Но вскоре после трансплантации
пациент погибает (Cooley
& Liotta 1969).
1973-1981. Группа В. Кольффа (США) быстро повышает
технические характеристики АИП сердец и в экспериментах на копытных доводит
рекорд времени их непрерывного использования до 268 дней (Kawai, Volder, Donovan et al 1974; Jarvik, Lawson, Olsen 1978; Smith, Jarvik, Lawson 1981).
1986. Установлен рекорд продолжительности жизни
пациента (Билл Шрёдер, США) с АИП сердцем в 620 дней (DeVries 1988).
1987-2000. В связи проблемами АИП устройств,
выявившихся при терапии Билла Шрёдера, внимание медицинского сообщества
переместилось в сторону потенциально более надёжных АНВ устройств. Их
использование начинает входить в клиническую практику. Впервые, помимо пульсирующих
устройств, разрабатываются прямоточные устройства с постоянным
кровотоком без пульса.
2001. Максимальные времена работы АНВ сердец у
некоторых пациентов преодолевают рекорд Билла Шрёдера 1986 года (Westaby, Siegenthaler, Beyersdorfm 2010).
2002-2010. Происходит дальнейшее развитие АНВ сердец,
максимальное зарегистрированное время непрерывной механической поддержки
пациентов регулярно увеличивается. Появляются АИВ насосы, такие как Heartmate II компании Thoratec. В этих устройствах компактность обеспечивается
прямоточной схемой. В 2007 году устройством Javrik-2000 (того же разработчика, что и у Javrick-7) установлен рекорд 7.5 лет (Westaby, Siegenthaler, Beyersdorf et al 2010).
2011. Б. Фразер и Б. Койн (США) впервые
устанавливают пациенту прямоточное АИП сердце, собранное из двух прямоточных
АИВ сердец Heartmate II. Ранее такая связка была опробована на
телёнке (Frazier, Cohn, Tuzun, et al 2009)
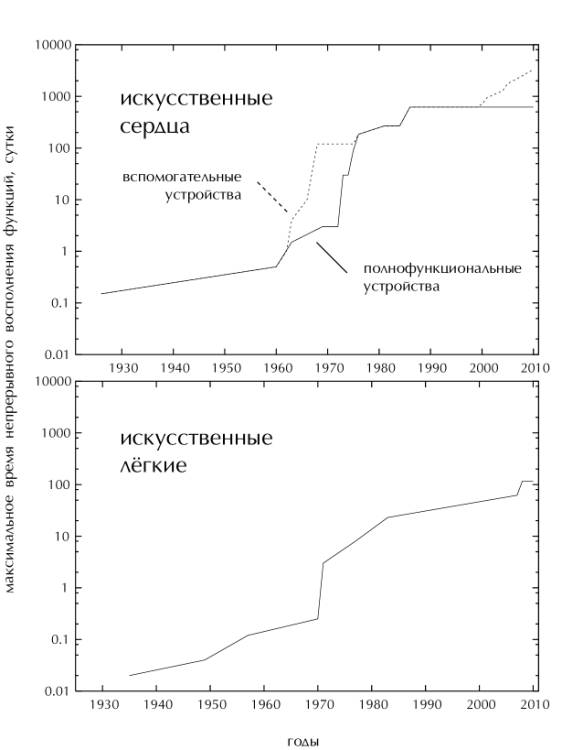
Рис.
2-4. Динамика роста возможностей аппаратов искусственного кровообращения.
Сплошная линия – полнофункциональные устройства, штриховая – вспомогательные
(пониженной мощности)
Динамика роста возможностей
На верхнем
фрагменте рис 2-4 приведены графики роста рекордных времён непрерывной работы
искусственных кровяных насосов. Отдельно приведены графики для полнофункциональных
(АСП и АИП) и вспомогательных устройств (АНВ и АИВ).
Основные проблемы
- Гемолиз -
разрушение эритроцитов.
В современных устройствах проблема в значительней степени решена
- Возможность
тромбообразования.
Требует использования антикоагулянтов, угрожающих кровотечениями. К 2000-м
годам удалось найти технические решения, существенно снижающие данный риск
в сравнении с 1980-ми годами
- Риск
проникновения инфекции.
Проблема актуальна, в основном, для портативных (не полностью имплантируемых)
устройств
- Возможность
отказа устройства.
Проблема актуальна, в основном, при долговременном использовании. Для
вспомогательных устройств, предусмотрена экстренная замена при отказе, для
полнофункциональных устройств, проблема стоит более остро
Рекорды
времени непрерывного восполнения функций
- Полнофункциональное
имплантируемое сердце –
620 дней, установлен в 1986 году. Стал результатом терапии,
проводившейся Биллу Шрёдеру с 1984 года и закончившейся смертью пациента.
Использовалось сердце Javrik-7, разработанное группой В. Кольффа (Devries 1988)
- Вспомогательное
сердце – 7.5
лет по состоянию на 2007 год, установлен в 2007 году. Стал
результатом терапии, проводившейся с 2000 года Питеру Хаутону. Использовалось устройство Javrik-2000 (Westaby, Siegenthaler, Beyersdorf et al 2010)
Перспективы
улучшения результатов.
Характеристики
АНВ и АИВ сердец регулярно улучшаются, и на этом пути не наблюдается
существенных затруднений. Ряд устройств, разработанных к середине 2000 годов,
пока что чисто по времени не имел возможности побить рекорды более старых
образцов. Что касается развития АИП сердец, то основной надеждой здесь является
двойной прямоточный Heartmate II (Frazier, Cohn, Tuzun, et al 2009), имплантированный пациенту в 2011
году. В качестве АИВ сердца Heartmate II
в отдельных случаях уже использовалось более 6 лет, и теоретически, нет
препятствий к тому, чтобы повторить эти результаты в качестве
полнофункционального устройства. Вполне вероятно, что в ближайшем будущем
искусственные устройства станут реальной альтернативой трансплантации сердца.
В контексте
вопросов радикальной киборгизации жизнеобеспечения, приведённые результаты
являются ещё более оптимистическими, так как после перевода значительной массы
тела на небиологическую основу, мощности даже вспомогательного устройства может
хватить для обеспечения полной циркуляции крови
2.22
Искусственные лёгкие
Основные
типы устройств
- АСП
оксигенаторы с прямым контактом крови и воздуха (плёночные, и пузырьковые
оксигенаторы). Совмещены с кровяным насосом. Допускают только
кратковременное использования, сегодня практически вышли из употребления
- АСП
оксигенаторы с мембраной между кровью и воздухом (ECMO). Совмещены с кровяным насосом. Сегодня
это наиболее широко используемые устройства
- АНВ оксигенаторы
(iLA). Способны
работать без собственного кровяного насоса. Теоретически наиболее безопасны и допускают долговременное
использование, но пока используются реже, чем стационарные устройства
История разработок
1935. Дж. Гиббон (США) разрабатывает первый в
мире АСП оксигенатор и использует его для поддержания жизни кошки в течение 26
минут (Gibbon 1970).
1953. Дж. Гиббон (США) при операции на
человеческом сердце впервые успешно применяет АСП сердце и лёгкие в течение 26
минут (Gibbon 1970)
1954-1959.
Время непрерывного
использования АСП оксигенаторов доводится до 8 часов, более длительное время
остаётся невозможным из-за наполнения крови пузырьками (Gibbon 1970)
1955. В. Кольфф и Р. Балзер (США) разрабатывают
первый экспериментальный образец мембранного оксигенатора, устраняющего
некоторые недостатки устройств с прямым контактом (Kolff
& Balzer 1955), но поначалу
изобретение не пользуется вниманием
1956-1971.
Происходит постепенное
совершенствование мебранного оксигенатора в экспериментах, оксигенатор обретает
коммерчески применимый вид (Baffes, Fridman, Bicoff, & Whitehill 1970)
1971. Дж. Хилл (США) впервые применяет АСП мембранный оксигенатор в
клинической практике, поддерживая жизнь пациента с острой лёгочной
недостаточностью в течение 3 дней (Hill, O'Brien, Murray et al 1972)
1972-1981.
Использование мембранного
оксигенатора входит в широкую клиническую практику, но главным образом - лишь
при лечении новорождённых (Bartlett, Gazzaniga, Fong, et al 1977). Постепенно повышается максимальное
время использования оксигенаторов
1982 Х Терасаки, К Ямаширо, К Цуно и др. (Япония)
в эксперименте поддерживают жизнедеятельность козы с помощью мембранного
оксигенатора в течение 23 дней (Terasaki, Yamashiro, Tsuno, et al 1983)
1983-2006. Характеристики устройств продолжают
совершенствоваться. В 2000-х гг Т. Крюммель устанавливает рекорд поддержания
времени жизни новорождённого с помощью АСП мембранного оксигенатора в течение
62 суток
2001. Компания Novalung (Германия) разрабатывает первый АНВ
оксигенатор (Carl 2002)
2005. Т Чициг, М Лаулэ, К Мелцер и Г Бауманн
(Германия) непрерывно поддерживают жизнь пациента с помощью АНВ лёгкого Novalung в течение 100 дней (Dschietzig, Laule, Melzer, Baumann, 2005)
2008. Ч Ванг, Ч Чоу, В Ко и Й Ли (Тайвань)
поддерживают жизнь пациента с помощью двух АСП мембранных оксигенаторов в
течение 117 дней (Wang, Chou, Ko, Lee 2010)
Динамика роста
возможностей
На нижнем фрагменте
рис. 2-4 показан рост максимального времени использования оксигенаторов. Хотя в
целом, результаты искусственных лёгких более слабы по сравнению с результатами
искусственных сердец, следует отметить устойчивый рост их характеристик
Основные проблемы
- Наполнение
крови пузырьками. В
мембранных оксигенаторах проблема устранена
- Возможность
тромбообразования.
Требует использования антикоагулятов, угрожающих кровотечением. При
использовании стационарных устройств, риск крайне высок, требуется
использование больших количеств антикоагулятов в сочетании с
обездвиживанием пациента. В портативных устройствах проблема в
значительной степени решена благодаря отсутствию в них насоса
- Гемолиз -
разрушение эритроцитов.
В современных устройствах проблема в значительной степени решена
- Риск
проникновения инфекции.
Проблема актуальна для всех типов устройств
- Травмирование
сосудов в местах
подключения устройств к кровотоку. Проблема акутальна, в основном,
для портативных устройств
Рекорды
времени использования устройств
- АСП
мембранные оксигенаторы
- 117 дней, установлен в 2008 году. Стал результатом
терапии, проводившейся с 2007 года
(Тайвань) и закончившейся восстановлением пациента (Wang, Chou, Ko, Lee 2010). Терапия проводилась персоналом
Тайбейскиого госпиталя
- АНВ
оксигенаторы – 100
дней, установлен в 2005 году. Стал результатом терапии,
проводившейся (Германия) и
закончившейся гибелью пациента (Dschietzig, Laule, Melzer, Baumann, 2005). Использовалось устройство
компании Novalung
Перспективы
улучшения результатов
Не смотря на
то, что текущий рекорд принадлежит стационарным устройствам, их длительное
использование остаётся крайне проблематичным. Даже исследованиям на животных в
этой области препятствует крайняя трудоёмкость и дороговизна. Что же касается
клинической практики, то здесь стационарные оксигенаторы и вовсе являются
крайним средством, применение которого даже в течение нескольких дней является
опасным. По-видимому, в ближайшее время рекорд стационарных устройств может
быть вновь (как в 2005 году) побит портативными устройствами. Не исключено, что
основным препятствием на пути значительного улучшения портативных оксигенаторов
является уже не конструкция самих устройств, а обеспечение качественного,
малотравматичного соединения их с кровотоком.
В контексте
задачи радикальной киборгизации системы жизнеобеспечения, малая мощность
вспомогательных устройств не является проблемой, к тому же, более просто может
быть реализовано и подключение оксигенатора к кровотоку. Но даже с учётом
этого, перспективы использования современных оксигенаторов в течение многих лет
остаются неясными и требуют дополнительных исследований на животных
2.23
Искусственная почка
Основные методы
очистки крови и типы устройств
- АСП
почки на базе гемодиализа.
Шлаки выводятся путём непосредственной очистки крови
- АСП и
АНП почки на базе перитонеального диализа. Шлаки выводятся путём очистки жидкости
брюшной полости, в которую они диффундируют из крови (Шутов 2010)
- ГН и ГИ
почки (renal assist device, bioartificial kidney) на основе человеческих клеток. Шлаки выводятся благодаря
функционированию клеток
История разработки
1923. Г. Гантер (Германия) в эксперименте
впервые осуществляет процедуру перитонеального диализа на морских свинках (Ganter 1923)
1924. Г. Хаас (Германия) впервые осуществляет
процедуру гемодиализа на людях в течение 15 минут (Haas 1925)
1938.
Дж. Веар, И. Сиск и А. Тринкл (США)
впервые успешно применяют перитонеальный диализ в клинической практике для
излечения уремии (Wear, Sisk, Trinkle 1938)
1944 Г. Фрэнк,
Дж. Файн и А. Селигман (США) в эксперименте поддерживают жизнедеятельность собак с удалёнными почками с
помощью перитонеального диализа в течение 10 суток (Seligman, Frank, Fine 1946)
1945. В. Кольфф (Нидерланды) впервые успешно применяет
аппарат гемодиализа (Kolff, Berk, ter Welle, et al 1944) для лечения
уремической комы. Кровь очищалась 11 часов
1950. А. Гролльман и Л. Тёрнер (США) в эксперименте поддерживают жизнедеятельность собак с
удалёнными почками с помощью перитонеального диализа до 70 суток (Grollman & Turner 1951)
1959. Б. Скрибнер и В. Квинтон (США) разрабатывают новый простой метод
подключения аппарата гемодиализа к кровотоку, позволяющий относительно
безопасно проводить регулярные процедуры (Quinton, Dillard, Cole, & Scribner 1961). П Дулан, Р Мёрфи и М Максвелл
разрабатывают катетеры для регулярного перитонеального диализа, и Р. Рубен
впервые применяет перитонеальный диализ как средство долговременного
восполнения функций почек (McBride 1985, Maxwell, Rockney, & Kleeman 1959)
1960. Гемодиализ впервые начинает применяться для долговременной терапии.
Один из первых экспериментальных пациентов, начавших курс в этом году, поставит
к 1996 году невиданный рекорд – 35 лет непрерывной терапии (ссылка будет
добавлена). Начиная с этого времени рекордная установленная продолжительность
жизни пациентов на гемодиализе растёт практически линейно, повторяя
естественный ход времени
1962. Открывается первый в мире медицинский центр, предоставляющий терапию
гемодиализа (США).
1963-1980. Технические характеристики устройств
повышаются, появляется возможность сократить время процедур с 8 до 4 часов, а
их частоту – до 2-3 раз в неделю
1976. Р. Попович и Дж. Монкриф (США) разрабатывают
АСП перитонеальный диализатор, допускающий домашнее применение (Popovich, Moncrief, Decherd et al 1976)
2003. Д. Юм, В. Вейцел, Р. Бартлетт и др. (США)
разрабатывают экстпериментальный образец ГН почки с человеческими клетками (Humes, Weitzel, Bartlett, et al 2004
2008. Д. Ли и М. Робертс представляют первый серийный АНП перитонеального
диализатора (Lee and Roberts 2008)
2009. Ш. Рой
и В. Фиссел разрабатывают первую экспериментальную ГИ почку (Fissel, Roy,
2009)
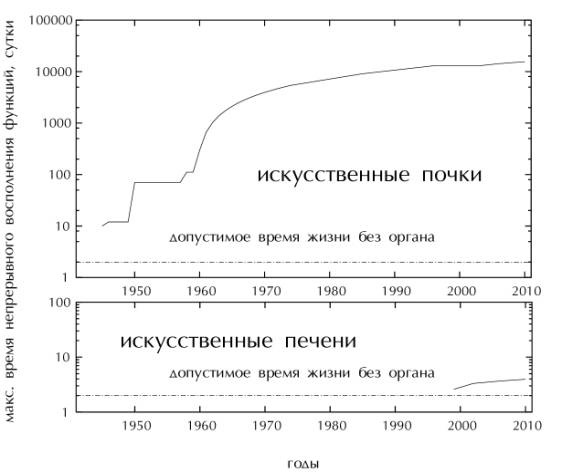
Рис.
2-5. Динамика роста возможностей аппаратов диализа. Штрихпунктирной линией
показано характерное допустимое время жизни крупных млекопитающих без
соответствующего органа
Динамика роста
возможностей
На верхнем фрагменте рис 2-5 приведёны
графики рекордных зарегистрированных продолжительностей
жизни людей и экспериментальных животных на почечном диализе в зависимости от
времени окончания терапии или эксперимента (регистрации рекорда). С 1960 года
рекорды растут, практически повторяя естественный ход времени (за год рекорд увеличивается
на год), и, в принципе, можно говорить, что при должном обслуживании прогноз
жизни пациентов почти неограничен . Помимо работ, упомянутых в истории
разработок, при построении графика использованы данные работ (Fine, Frank,
and
Seligman 1946; Schloerb 1958)
Основные проблемы
·
Травмирование сосудов.
Более характерно для гемодиализа. В настоящее время значительной степени
минимизировано
·
Возможность тромбообразования.
Риск более характерен для гемодиализа. В настоящее время значительно уменьшен
·
Риск перитонита.
Характерен для перитонеального диализа
·
Человеческий фактор.
Трудность поддержания высокого качества терапии персоналом и пациентами в
течение долгого времени
·
Риск проникновения инфекции
·
Как общий результат вследствие множества
факторов – значительное отставание среднего времени жизни пациентов (порядка
10-17 лет) от максимального зарегистрированного времени
Рекорд
времени непрерывного восполнения функций
41 год,
установлен в 2010 году. Стал результатом терапии, проводившейся Сюзан Вильямс с
1969 года, терапия продолжается (ссылка будет добавлена в полной редакции)
Перспективы
улучшения результатов
Поскольку
текущий рекорд определён временем начала массового использования устройств, нет
оснований связывать его с принципиальными техническими ограничениями.
По-видимому, рекорд будет побит в ближайшем будущем. Более сложной проблемой
является увеличение средней продолжительности жизни, которое определяется
большим количеством факторов. По-видимому, средние результаты обещают
существенно вырасти, когда появятся образцы ГИ почек, не требующие
ответственного обслуживания. Однако пока такие устройства являются лишь
экспериментальными
В контексте
вопроса радикальной киборгизации, задача искусственного восполнения почечных
функций в значительной степени является решённой, и на первый план выходят
такие проблемы как дороговизна процедур и громоздкость оборудования. По
видимому, эти проблемы в перспективе могут быть решены ГИ устройствами
2.24
Искусственная печень
Основные
типы устройств
- АСВ печени
на базе почечного гемодиализа. Выводят из крови водорастворимые токсины (в первую очередь,
аммиак). Восполняют лишь одну, хотя и важную, функцию печени
- АСВ печени
на базе альбуминового диализа. Выводят из крови белковосвязываемые токсины. Обычно используются в
связке с почечным гемодиализатором
- ГНВ печени
(bioartificial liver, liver assist device) – устройство на базе биологических
клеток печени млекопитающих. Теоретически способно замещать все функции
печени, но на практике имеет ряд проблем, препятствующих полной
функциональности
История разработок
1955 Дж. Кили, Х. Велч и др. (США) демонстрируют
возможность очистки крови от аммака с помощью гемодиализатора – искусственной
почки В. Кольффа (Kile, Welch, Pender, & Welch 1956)
1958. Д. Шечтер, Т. Неалон и Дж. Гиббон (США)
конструируют специализированный гемодиализатор для очистки крови от аммиака (Schechter, Nealon, Gibbon 1958). Дж. Кили, Дж. Пендер и др. показывают
возможность клинического применения гемодиализа для лечения интоксикации при
почечной недостаточности (Kiley, Pender, Welch & Welch
1958)
1959. С. Кимото (Япония) собирает первую цепь
печеночного диализа из искусственных устройств и живых собак, печени которых
используются для очистки человеческой крови не только от аммиака, но и от других
токсинов (Kimoto 1959)
1963. Ю Носе, Дж Миками, Ё Касаи и др. (США,
Япония) демонстрируют первый в мире экспериментальный образец ГНВ печени на
основе клеток печени собаки (Nosé,
Mikami, Kasai, et al 1963)
1993. ГНВ печень А. ДеМитриу (США) на основе
клеток свиньи впервые использована для поддержания здоровья пациентки с
удалённой печенью в течение 14 часов (в ожидании трансплантации). Не смотря на
то, что человек способен выжить без печени в течение даже большего времени,
искусственная печень позволила избежать характерных вредных токсических
эффектов, которые неизбежно бы накопились
1999. Л. Флендриг, Ф. Калисе, Е Ди Флорио и др.
(Нидерланды) в эксперименте поддерживают жизнедеятельность свиней с полной
печёночной ишемией (фактически, не работающая печень) с помощью ГНВ печени до
63 часов – результат, впервые статистически достоверно превышающий характерное
естественное время жизни свиней без органа (Flendrig, Calise, Di Florio 2001)
2001. Г. Уллерих, В. Авенхаус, Дж. Менцел и др.
(Германия) разрабатывают первый коммерчески применимый АСВ альбуминовый
диализатор MARS (Ullerich, Avenhaus, Menzel 2001)
2010. Х. Арора, Дж. Теккекендам, Л. Теше и др. (США) поддерживают жизнь пациента с неработающей (часть времени – полностью отсутствющей) печенью в течение 95 часов (Arora, Thekkekandam, Tesche et al 2010)
Динамика роста
возможностей
На нижнем
фрагменте рис 2-5 приведён график роста рекордных времён полного искусственного
восполнения печеночной функции млекопитающих. Помимо работ, упомянутых в
истории разработок, при построении графика использованы данные работ (Sosef, Abrahamse, and van de Kerkhove 2002; Knubben 2006). В отличие от всех рассмотренных выше
искусственных органов, результаты искусственных печеней пока крайне скромны и
лишь недавно превысили характерное естественное время жизни млекопитающих без
органа
Основные проблемы
- Многочисленность
функций печени. Очистка
крови от множества разных токсинов затруднительна в реальном времени, аппаратное
восполнение некоторых других функций вовсе пока не реализовано
- Возможность
тромбообразования. Риск
растёт по мере усложнения аппарата и удлинения пути крови внутри
устройства
- Необходимость
отдельной системы жизнеобеспечения для биологических клеток гибридных устройств. Она должна
состоять, как минимум, из кровяного насоса, оксигенатора и источника
питательных веществ.
- Необходимость
сохранения не только
жизнеспособности,
но и функциональности биологических клеток гибридных устройств
- Необходимость
биосовместимого иммунологического барьера между клетками животного и
кровью человека в
гибридных устройствах
Перспективы улучшения результатов
Создание
полнофункциональной искусственной печени в обозримом будущем, по-видимому,
возможно лишь в гибридном варианте. Здесь нет принципиальных ограничений,
необходимо лишь обеспечить более высокую мощность и надёжность устройств.
В контексте
вопроса радикальной киборгизации ЖОК, длительно применимыми могут оказаться и
полностью искусственные устройства. Благодаря сокращению биологических
компонент, нагрузка на диализатор может быть существенно снижена, а набор
необходимых функций – уменьшен. Для выяснения реальных возможностей
альбуминовых диализаторов в этом контексте требуются эксперименты на животных
2.25
Искусственное (парентеральное) питание
Основные подходы
- Кратковременное
питание через капельницы
- Долговременное
питание через имплантируемые порты, соединённые с портативными
резервуарами веществ (Dudrick, O'Donnell, Englert 1984)
История разработок
1656. К. Врен (Англия) проводит опыты по вливанию
алкогольных напитков и опиатов в кровоток собак
1896. А Бейдл и Р. Крауц (Германия) проводят первые
опыты по питанию человека путём внутривенного введения глюкозы
1915. Р Вудъятт, В Сансум и Р Вилдер (США) вводят
парентеральное питание глюкозой в клиническую практику (Woodyatt, Sansum, and Wilder 1915). Эти опыты позволяют
обеспечивать больных энергетическим источником, однако не решают проблему
снабжения белками и жирами
1935. В. Роуз (США) формулирует требования к набору
аминокислот, необходимых для долговременного питания (Rose 1937)
1937. Р. Элман (США) проводит первые опыты по белковому
парентеральному питанию человека (Elman 1937)
1939. Р. Элман и Д. Вэйнер (США) разрабатывают клинически
применимые методы белоковосодержащего парентерального питания (Elman, Weiner 1939)
1957. К. Маер, Дж. Фэнчер, П. Шурр и Х. Вебстер (США)
разрабатывает Липомул - первый препарат для парентерального снабжения человека
жировыми компонентами (Meyer, Fancher, Schurr and Webster, 1957). В дальнейшем, этот препарат оказывается токсичным
1961. А Ретлинд (Швеция) разрабатывает Интралипид –
первый безопасный препарат для парентерального снабжения жирами
1966. С Дадрик, Д Вильмор и др. (США) разрабатывают смесь
для полноценного внутривенного искусственного питания и поддерживают жизнь
щенков с её помощью в течение 267 дней (Dudrick, Wilmore 1968)
1967. Те же авторы применяют свой метод для
жизнеобеспечения младенца с болезнью кишечника (не имеющего возможности
питаться обычным образом) в течение 22 месяцев (Wilmore, Dudrick 1968). С этого момента
долговременное парентеральное питание начинает входить в широкую клиническую
практику
1972. Начинают выпускаться готовые смеси для полного
парентерального питания, включающие все основные компоненты (ссылка будет
добавлена в полной редакции)
1973. Дж. Бровиак, Дж. Коул и Б. Скрибнер (США)
разрабатывают первый полностью имплантируемый порт для долговременного
парентерального питания (Broviac, Cole, Scribner 1973). С
этого момента становится возможным парентеральное питание дома и в условиях
практически полной мобильности пациента
Динамика роста
возможностей
График роста
максимальной продолжительности жизни пациентов и экспериментальных животных на
полностью парентеральном питании будет построен в будущей редакции главы,
однако уже сейчас можно сказать, что он в общих чертах повторяет аналогичный
график для искусственных почек. С конца 1960-х годов начинается почти линейный
рост показателей, свидетельствующий об отсутствии принципиального технического
ограничения на максимальное время искусственного питания
Основные проблемы
- Риск
проникновения инфекций
из-за нарушения стерильности препарата или инструментов
- Травмирование
сосудов в месте
контакта устройств с кровотоком
- Возможность
тромбообразования в
месте контакта устройств с кровотоком
Перспективы улучшения результатов
Дальнейшее
развитие области, по-видимому, будет идти по пути дальнейшего увеличения безопасности
использования имплантируемых портов, обеспечения удобства пациента и уменьшении
риска проникновения инфекций, а также удешевления препаратов
В контексте
вопросов киборгизации системы жизнеобеспечения можно сказать, что
парентеральное питание уже в существующем виде может эффективно применяться
Список литературе к главе 2
· Брюхоненко СС, Чечулин СИ (1926). Опыты по изолированию головы собаки (с демонстрацией прибора) // Труды II Всесоюзного съезда физиологов. — Л.: Главнаука, — С. 289-290
- Гришманов ВЮ,
Лебединский КМ (2000). Искусственное питание: концепции и возможности //
Мир Медицины (3-4), 26-32 С. [http://medi.ru/doc/8500309.htm]
- Лапчинский АГ
(1964). С. С. Брюхоненко — основоположник искусственного кровообращения:
Краткий биографический очерк // Искусственное кровообращение. — М.:
Медицина — С. 612
- Шутов ЕВ
(2010). Перитонеальный диализ – М - 153 с
·
Arora
H, Thekkekandam J, Tesche L,
Sweeting R, Gerber DA, Hayashi
PH (2010). Long-term survival after 67 hours of anhepatic state due to primary
liver allograft nonfunction // Liver Transplantation 16 (12), 1428–1433
- Baffes
TG, Fridman JL, Bicoff JD, Whitehill JL (1970), Extracorporeal circulation
for support of palliative cardiac surgery in infants // Ann Thorac Surgery
10, 354-363
- Bartlett
RH, Gazzaniga AB, Fong SW, Jefferies MR, Roohk HV, Haiduc N (1977).
Extracorporeal membrane oxygenator support for cardiopulmonary failure //
J Thorac Cardiovascular Surgery 73, 375-386
- Bernhard
WF, LaFarge CG, Robinson T, Yun I, Shirahige K, Kitrilakis S (1968). An
improved blood-pump interface for left-ventricular bypass // Ann Surg 168
(4):
750–764
[http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1387509]
- Broviac
J, Cole J, Scribner B (1973). A silicone rubber atrial catheter for
prolonged parenteral hyperalimentation // Surg Gynecol Obstet 136: 602-606
- Carl
MD (2002). Novalung[R] iLA membrane ventilator indications and practical
applications - Talheim: Novalung GmgH Egerten 3 D-74388
·
Cooley
DA, Liotta D, Hallman GL, Bloodwell RD, Leachman RD, Milan JD (1969). First
human implantation of cardiac prosthesis for total replacement of the heart //
Transactions of American Society Artif. Internal Organs 15: 252
·
DeBakey ME (1971). Left ventricular bypass pump for cardiac
assistance // American J Cardiol 27: 3-11
·
Doshi N, Zahr AS, Bhaskar S, Lahann J, Mitragotri S (2009). Red
blood cell-mimicking synthetic biomaterial particles // Proc
National Acad Sci of the United States of America 106,
51, 21495-21499
- Dschietzig T, Laule M, Melzer C, Baumann
G (2005). Long-term treatment of severe respiratory failure with an extracorporeal lung assist — a case report // Intensivmed
42, 365–370
- Dudrick
SJ, O'donnell JJ, Englert DM, Matheny RG, Blume EE, Nutt RE, Hickey MS,
Barroso AO (1984). 100
Patient-Years of Ambulatory Home Total Parenteral Nutrition // Ann Surg
199: 770-781 [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1353466/pdf/annsurg00124-0158.pdf]
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE (1968). Long-term
total parenteral nutrition with growth, development and positive nitrogen balance // Surgery
64: 134-142
- Elman
R (1937). Amino acid content
of the blood following intravenous injection of hydrolysed casein // Proc
Society Exp Bio Med 37: 437–440
- Elman
R, Weiner DO (1939). Intravenous alimentation with special reference to
protein (amino acid) metabolism // J American Med Assoc 112 (9), 796-802
- Fine
J., Frank HA, Seligman AM (1946). Treatment of acute renal
failure by peritoneal irrigation // Ann. Surg 124: 857–878.
- Fissell WH, Roy S (2009).
The implantable artificial kidney
// Semin Dial 22 (6): 665-670.
- Flendrig LM, Calise F, Di Florio E, Mancini A, Ceriello A, Santaniello W, Mezza E, Sicoli F, Belleza G, Bracco A, Cozzolino S, Scala D, Mazzone M, Fattore M, Gonzales E, Chamuleau RA (1999).
Significantly improved survival time in pigs with complete liver ischemia
treated with a novel bioartificial liver // International J Artif Organs
22 (10): 701-709
·
Frazier
OH, Cohn WE, Tuzun E, Winkler JA, Gregoric ID (2009). Continuous-flow total
artificial heart supports long-term survival of a calf // Texas Heart Institute
J 36 (6), 568-574
- Ganter G (1923).
Uber die beseitigun
giftiger stoffe aus dem blute durch dialyse // Munch Med Wochenschr 70:
1478-1480
- Gibbon JH (1970). The development of the heart-lung apparatus // Rev Surg 27: 231
- Grollman
A, Turner LB, Mc LJ (1951). Intermittent
peritoneal lavage in nephrectomized dogs and its application
to the human being // American Med Association Arch Intern Med 87:379–390
- Haas G (1925). Versuche der Blutauswaschung am
Lebenden mit Hilfe der Dialyse // Klin Wochenschrift 4: 13
- Hill
JD, O'Brien TG, Murray JJ, Dontigny L, Bramson ML, Osborn JJ, Gerbode F
(1972). Prolonged extracorporeal oxygenation for acute post-traumatic
respiratory failure (shock-lung syndrome). Use of the Bramson membrane
lung // New England J
Med 286(12):
629–634
- Humes HD, Weitzel WF, Bartlett RH, Swaniker FC, Paganini EP, Luderer JR, Sobota J (2004). Initial clinical results of the bioartificial
kidney containing human cells in ICU patients with acute renal failure //
Kidney Intl, 66, 4, 1578-1588
- Jarvik RK, DeVries WC, Semb BK, Koul B, Copeland
JG, Levinson
MM, Griffith
BP, Joyce
LD, Cooley
DA, Frazier
OH et al (1981) Scientific American 244: 74
- Jarvik RK; Lawson JH; Olsen DB; Fukumasu H; Kolff
WJ (1978). The beat goes on: status of the artificial heart, 1977 // Int J
Artif organs 1 1 21–7
- J
Kawai, J Volder, F M Donovan, and W J Kolff (1974) Ann Surg. 179(3): 362–371 14 дней в 1973 [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1355900/]
·
Kiley JE, Pender JC, Welch
HF,
Welch CS (1958) Ammonia Intoxication Treated by
Hemodialysis // New England J Med; 259:1156-1161
- Kiley JE, Welch HF, Pender JC,
Welch CS: Removal of
blood ammonia by
hemodialysis. Proc Soc Exp Biol Med 1956
- Kimoto S (1959). The artificial liver experiments and
clinical application // Transactions of Americal Society for Artificial
Internal Organs 5, 102-110
·
Knubben
M (2006). Transplantation: 82 1 свиньи до 88.5 часов
·
Kolff
WJ, Berk H Th J, ter Welle M, van der Ley A J W, van Dijk E C, van Noordwijk J (1944).
The Artificial Kidney: a dialyser with a great area // Acta Medica Scandinavica
117, 2, 121–134
·
Kolff, WJ and Balzer R, "The Artificial Coil
Lung", Transactions of the American Society for Artificial Internal
Organs, 1 (1955), 39-42
·
Liotta D, Taliani T, Giffoniello
AH, Sarria Deheza F, Liotta S, Lizarraga R, Tolocka R, Pagano J, Biancciotti E (1961) Artificial heart in the
chest: Preliminary report. Trans Am Soc Artif Intern Organs;7:318–22
·
Lu S-J, Feng Q, Park J S, Vida L, Lee B-S, Strausbauch M,
Wettstein P J, Honig G R, & Lanza R (2008), Biological properties and
enucleation of red blood cells from human embryonic stem cells // Blood, 112, 12, 4475-4484
·
Meyer
CE, Fancher JA, Schurr PE and Webster HD (1957): Composition, Preparation and
Testing of an Intravenous Fat Emulsion // Metabolism, 6: 591-596
·
Maxwell MH, Rockney RE, and Kleeman CR. Peritoneal
dialysis, techniques and application // JAMA 1959; 170:917-924
·
Mazur
ML (2003). Longest survivor? Taking good care of his diabetes has helped Karl
Smith stay in good health for the 81 years he's been on insulin // Diabetes
Forecast 56 (6): 57-58
·
McBride P. Paul Doolan and
Richard Rubin: performed the first successful chronic peritoneal dialysis // Peritoneal
Dialysis Int 1985; 5: 84–86
·
Nichols
J E, Cortiella J, Lee J, Niles J A, Cuddihy M, Wang S, Bielitzki J, Cantu A,
Mlcak R, Valdivia E, Yancy R, McClure ML, Kotov N A (2009). In vitro analog of
human bone marrow from 3D scaffolds with biomimetic inverted colloidal crystal
geometry // Biomaterials. 30(6), 1071-1079
- Nosé
Y, Mikami J, Kasai Y, Sasaki E, Agishi T, Danjo Y (1963) An experimental
artificial liver utilizing extracorporeal metabolism with sliced or
granulated canine liver // Tr Am Soc Artif Intern Org 9:358-362,
- Popovich RP, Moncrief JW, Decherd JF, Bonar JB, Pyle WK (1976). The
definition of a novel portable/wearable equilibrium peritoneal dialysis technique // Transactions
of American Society Artif Internal Organs; 64: 5
- Quinton WE, Dillard DH., Cole
JJ & Scribner BH (1961). Possible improvements in the technique
of long-term cannulation of blood-vessels // Transactions
of American Society Artif Internal Organs 7, 60
- Riess
J G, Le Blanc M (1978). Perfluoro Compounds as Blood Substitutes // Angewandte Chemie Int Ed EngI 17, 621-634
- Rose WC
(1937) The nutritive significance of the amino acids
and certain related compounds // Science, 86: 298-300
- Sosef
MN, Abrahamse LS, van de Kerkhove MP, Hartman
- R,
Chamuleau RA, van Gulik TM (2002). Assessment of the AMC-bioartificial
liver in the anhepatic pig. Transplantation; 73: 204-209 2002 свиньи до 80 часов
·
Schechter DC, Nealon TF, jr, Gibbon
JH (1958), Jr A simple extracorporeal device for reducing elevated blood
ammonia levels; preliminary report // Surgery ;44(5):892–897
- Seligman AM, Frank HA, Fine J (1946). Treatment of Experimental Uremia
by Means of Peritoneal
Irrigation // J
Clin Invest 25: 211–219
·
Terasaki H; Yamashiro K; Tsuno K; Kaneko T; Koda H; Nogami T; Otsu T, Ezaki K, Hashiguchi A, Morioka T
Experimental ECMO for 23 days in a goat // Masui. 1983 Jan;32(1):21-9 – рекорд 23 дня
·
Ullerich H; Avenhaus W; Menzel J; Dietl
KH;
Domschke W; Lerch MM. MARS (Molecular Adsorbent
Recycling System) as a novel hepatic detoxification procedure until orthotopic liver
transplantation // Z Gastroenterol. 2001 39(12):1023-1026
- Wear
J, Sisk I, Trinkle A (1938). Peritoneal lavage in the treatment of uremia // J Urol
39: 53–62
·
Wang
ChH, Chou ChCh, Ko WJ, Lee YCh (2010) Rescue a drowning patient
by prolonged extracorporeal membrane oxygenation support for 117 days // American Journal of Emergency Medicine 28 (6)
·
Westaby S, Siegenthaler M, Beyersdorf F, Massetti M, Pepper
J, Khayat A, Hetzer R and OH Frazier (2010). Destination therapy with a rotary blood pump and novel
power delivery // European Journal of Cardio-Thoracic Surgery 37, 2,
350-356
·
Wilmore
DW, Dudrik SJ. (1968) Growth
and development of an infant receiving all nutrients exclusively by vein // J
American Med Assoc 203: 860–864
- Woodyatt R T, Sansum
W D, and Wilder R M (1915). Prolonged and
Accurately-timed Intravenous Injection of Sugar // J. American Medical
Association,.65, 2067